Informacion proporcionada por:
Wikipedia biblioteca interactiva
miércoles, 29 de febrero de 2012
miércoles, 22 de febrero de 2012
Conclusiones
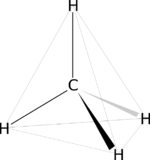
- Hay que pensar que la molécula armada es solo una de las tantas formas que puede adoptar una molécula.
- Podemos concluir que de todos los confórmeros posibles, la molécula adoptara la mayor parte de tiempo solo un de ellos. La molécula buscara la conformación mas cómoda o mas estable, o sea la conformación en donde las interacciones sean mínimas.
- Para cada compuesto nuevo que se descubre sería bueno tratar de llevarlo a modelos moleculares ya que no podría dar una ayuda acerca de los efectos estéricos que pueda tener en relación con otras moléculas adyacentes.
Proceso
Un proceso químico es un conjunto de operaciones químicas o físicas ordenadas a la transformación de unas materias iniciales en productos finales diferentes. Un producto es diferente de otro cuando tenga distinta composición, esté en un estado distinto o hayan cambiado sus condiciones.
En la descripción general de cualquier proceso químico existen diferentes operaciones involucradas. Unas llevan inherentes diversas reacciones químicas. En cambio otros pasos son meramente físicos, es decir, sin reacciones químicas presentes. Podemos decir que cualquier proceso químico que se pueda diseñar consta de una serie de operaciones físicas y químicas. Cada una de estas operaciones es una operación unitaria dentro del proceso global.
En la descripción general de cualquier proceso químico existen diferentes operaciones involucradas. Unas llevan inherentes diversas reacciones químicas. En cambio otros pasos son meramente físicos, es decir, sin reacciones químicas presentes. Podemos decir que cualquier proceso químico que se pueda diseñar consta de una serie de operaciones físicas y químicas. Cada una de estas operaciones es una operación unitaria dentro del proceso global.
Marco Teorico Referencial
Marco Teórico
Hidrocarburos: Son compuestos orgánicos cuyas moléculas están constituidas exclusivamente por átomos de Carbono e Hidrógeno. Dentro de esta familia se encuentra los Alcanos, Alquenos y Alquinos.
Alcanos: Los hidrocarburos saturados de cadena abierta forman un grupo homólogo denominado alcanos o parafinas. La composición de todos los miembros del grupo responde a la fórmula CnH2n +2, donde n es el número de átomos de carbono de la molécula. Los cuatro primeros miembros del grupo son el metano, CH4, el etano, C2H6, el propano, C3H8 y el butano, C4H10. Todos los miembros alcanos son inertes, es decir, no reaccionan fácilmente a temperaturas ordinarias con reactivos como los ácidos, los álcalis o los oxidantes. Los primeros cuatro miembros del grupo son gases a presión y temperatura ambiente; los miembros intermedios
son líquidos, y los miembros más pesados son semisólidos o sólidos.
Petróleo: Petróleo, líquido oleoso bituminoso de origen natural compuesto por diferentes sustancias orgánicas. También recibe los nombres de petróleo crudo, crudo petrolífero o simplemente “crudo”. Se encuentra en grandes cantidades bajo la superficie terrestre y se emplea como combustible y materia prima para la industria química. Las sociedades industriales modernas lo utilizan sobre todo para lograr un grado de movilidad por tierra, mar y aire impensable hace sólo 100 años. Además, el petróleo y sus derivados se emplean para fabricar medicinas, fertilizantes, productos alimenticios, objetos de plástico, materiales de construcción, pinturas y textiles, y para generar electricidad.
Todos los tipos de petróleo se componen de hidrocarburos, aunque también suelen contener unos pocos compuestos de azufre y de oxígeno; el contenido de azufre varía entre un 0,1 y un 5%. El petróleo contiene elementos gaseosos, líquidos y sólidos. La consistencia del petróleo varía desde un líquido tan poco viscoso como la gasolina hasta un líquido tan espeso que apenas fluye. Por lo general, hay pequeñas cantidades de compuestos gaseosos disueltos en el líquido; cuando las cantidades de estos compuestos son mayores, el yacimiento de petróleo está asociado con un depósito de gas natural.
Existen tres grandes categorías de petróleo crudo: de tipo parafínico, de tipo asfáltico y de base mixta. El petróleo parafínico está compuesto por moléculas en las que el número de átomos de hidrógeno es siempre superior en dos unidades al doble del número de átomos de carbono. Las moléculas características del petróleo asfáltico son los naftenos, que contienen exactamente el doble de átomos de hidrógeno que de carbono. El petróleo de base mixta contiene hidrocarburos de ambos tipos.
Betún: Betún, cualquiera de las diversas mezclas naturales de hidrocarburos con sus derivados no metálicos. El petróleo sin procesar, el asfalto y el alquitrán son betunes, tienen un color castaño oscuro o negro característico y contienen poco nitrógeno, oxígeno o azufre. En el aspecto comercial la palabra betún se refiere sobre todo a los hidrocarburos en estado sólido o semisólido, pero en un sentido más amplio se refiere a todos los hidrocarburos naturales, que pueden encontrarse también en estado líquido o gaseoso. El betún, repartido por muchos lugares del mundo, se encuentra en todos los estratos formados desde el precámbrico hasta el cuaternario. En la antigüedad el betún era el nombre romano de un asfalto usado como cemento y argamasa.
Cera Carnauba: La cera llamada carnauba se acumula en forma de escamas en el envés de las hojas; para extraerla, se recolectan las hojas, se dejan secar y se agitan. Se aplica en la fabricación de lubricantes, pulimentos, ceras para suelos, plásticos y papel carbón.
Parafina: La cera de parafina es una mezcla de hidrocarburos saturados de alta masa molecular que se produce al refinar el petróleo. Actualmente la mayoría de las ceras comerciales proceden del petróleo.
Carbón: combustible sólido de origen vegetal. El carbón se empieza a formar durante el periodo carbonífero, cuando las plantas quedaron enterradas bajo los sedimentos. La formación de carbón continúa, de forma intermitente, hasta el periodo terciario.
Vaselina: Sustancia grasa, con aspecto de cera, que se saca de la parafina y aceites densos del petróleo y se usa en farmacia y perfumería.
Objetivos
Objetivos
- La finalidad de esta asignatura es completar y ampliar la formación adquirida por los alumnos en Química Orgánica general con nuevos contenidos de mayor especificidad ynivel en esta área de conocimiento, así como profundizar en algunos aspectos ya tratadosde forma básica en cursos anteriores pero que por su trascendencia resulta convenientevolver a considerar con una visión más amplia y crítica.
En el presente curso de Química Orgánica Avanzada se pretende del alumno:
- Conseguir el dominio de los conceptos teóricos y prácticos relacionados con la Mecanística de las reacciones. La utilización de aspectos estereoquímicos, termodinámicos, cinéticos ycatalíticos como ayuda en la interpretación del mecanismo por el que transcurre una reacciónquímica.
- Alcanzar el conocimiento de las técnicas empleadas en la investigación de mecanismos de reacción. Distinción de los diferentes pasos que los componen y clasificación del tipo dereacciones que se producen en procesos complejos. Adquisición de la capacidad para diseñarun posible mecanismo de reacción lógico y válido para un proceso químico experimentaldescrito en cuanto a reactivos, condiciones de reacción y productos.
- Profundizar en el estudio de la filosofía y estrategias propias de la Síntesis Orgánica, manejo de reactivos, condiciones y secuencias de reacción para la obtención de estructurasquímicas más complejas.
- Adquirir los conocimientos básicos relativos a nomenclatura, propiedades, reactividad y procedimientos de obtención en Química Orgánica Heterocíclica.
- Realizar un estudio introductorio en el campo de los Productos Naturales en cuanto a las secuencias biosintéticas y a la descriptiva de las familias de compuestos de mayor interés.
Introduccion
Historia
La química orgánica se constituyó como disciplina en los años treinta. El desarrollo de nuevos métodos de análisis de las sustancias de origen animal y vegetal, basados en el empleo de disolventes como el éter o el alcohol, permitió el aislamiento de un gran número de sustancias orgánicas que recibieron el nombre de "principios inmediatos". La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas, era necesaria la intervención de lo que llamaban ‘la fuerza vital’, es decir, los organismos vivos. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquellos que contienen carbono e hidrógeno, y otros elementos (que pueden ser uno o más), siendo los más comunes: oxígeno, nitrógeno, azufre y los halógenos.[editar] Cronología
Artículo principal: Cronología de la Química orgánica
[editar] Fuentes de información
La tarea de presentar la química orgánica de manera sistemática y global se realizó mediante una publicación surgida en Alemania, fundada por el químico Friedrich Konrad Beilstein (1838-1906). Su Handbuch der organischen Chemie (Manual de la química orgánica) comenzó a publicarse en Hamburgo en 1880 y consistió en dos volúmenes que recogían información de unos quince mil compuestos orgánicos conocidos. Cuando la Deutsche chemische Gesellschaft (Sociedad Alemana de Química) trató de elaborar la cuarta re-edición, en la segunda década del siglo XX, la cifra de compuestos orgánicos se había multiplicado por diez. Treinta y siete volúmenes fueron necesarios para la edición básica, que aparecieron entre 1916 y 1937. Un suplemento de 27 volúmenes se publicó en 1938, recogiendo información aparecida entre 1910 y 1919. En la actualidad, se está editando el Fünftes Ergänzungswerk (quinta serie complementaria), que recoge la documentación publicada entre 1960 y 1979. Para ofrecer con más prontitud sus últimos trabajos, el Beilstein Institut ha creado el servicio Beilstein Online, que funciona desde 1988. Recientemente, se ha comenzado a editar periódicamente un CD-ROM, Beilstein Current Facts in Chemistry, que selecciona la información química procedente de importantes revistas. Actualmente, la citada información está disponible a través de internet.[editar] La química del carbono
La gran cantidad de compuestos orgánicos que existen tiene su explicación en las características del átomo de carbono, que tiene cuatro electrones en su capa de valencia: según la regla del octeto necesita ocho para completarla, por lo que forma cuatro enlaces (valencia = 4) con otros átomos. Esta especial configuración electrónica da lugar a una variedad de posibilidades de hibridación orbital del átomo de Carbono (hibridación química).Véase también: Hibridación (química)
Véase también: Estructura de Lewis
La molécula orgánica más sencilla que existe es el Metano. En esta molécula, el Carbono presenta hibridación sp3, con los átomos de hidrógeno formando un tetraedro.El carbono forma enlaces covalentes con facilidad para alcanzar una configuración estable, estos enlaces los forma con facilidad con otros carbonos, lo que permite formar frecuentemente cadenas abiertas (lineales o ramificadas) y cerradas (anillos)
[editar] Hidrocarburos
El compuesto más simple es el metano, un átomo de carbono con cuatro de hidrógeno (valencia = 1), pero también puede darse la unión carbono-carbono, formando cadenas de distintos tipos, ya que pueden darse enlaces simples, dobles o triples. Cuando el resto de enlaces de estas cadenas son con hidrógeno, se habla de hidrocarburos, que pueden ser:- Saturados: con enlaces covalentes simples, alcanos.
- Insaturados, con dobles enlaces covalentes (alquenos) o triples (alquinos).
- Aromáticos: estructura cíclica.
[editar] Radicales
Los radicales son fragmentos de cadenas de carbonos que cuelgan de la cadena principal. Su nomenclatura se hace con la raíz correspondiente (en el caso de un carbono met-, dos carbonos et-...) y el sufijo -il. Además, se indica con un número, colocado delante, la posición que ocupan. El compuesto más simple que se puede hacer con radicales es el 2-metilpropano. En caso de que haya más de un radical, se nombrarán por orden alfabético de las raíces. Por ejemplo, el 2-etil, 5-metil, 8-butil, 10-docoseno.[editar] Isómeros
Ya que el carbono puede enlazarse de diferentes maneras, una cadena puede tener diferentes configuraciones de enlace dando lugar a los llamados isómeros, moléculas con la misma fórmula química pero con distintas estructuras y propiedades.[editar] Grupos funcionales
Los compuestos orgánicos también pueden contener otros elementos, también grupos de átomos, llamados grupos funcionales. Un ejemplo es el grupo hidroxilo, que forma los alcoholes: un átomo de oxígeno enlazado a uno de hidrógeno (-OH), al que le queda una valencia libre.[editar] Oxigenados
Suscribirse a:
Entradas (Atom)